Von der Forschung bis zum Medikament

Du und deine behandelnden Ärzt*innen stellen an die Behandlung deiner chronisch-entzündlichen Darmerkrankung (CED) gewisse Anforderungen: Deine Lebensqualität und die Symptome deiner CED sollten schnellstmöglich verbessert und dieser Zustand langfristig beibehalten werden. Dabei solltest du jedoch eine dauerhafte Einnahme von Steroiden vermeiden1,2 – weshalb erfährst du in unserem Artikel Steroidabhängigkeit: Wenn aus einem kurzen Vor- ein langer Nachteil wird. Bei solchen Therapieentscheidungen können medizinische Behandlungsleitlinien deine Ärzt*innen unterstützen. Mehr dazu kannst du in unserem Artikel Leitliniengerechte Therapieziele auf Basis eigener Bedürfnisse lesen. Zur Behandlung deiner CED stehen zwar verschiedene Strategien zur Verfügung, doch wirken Medikamente nicht bei allen CED-Betroffenen gleich gut, wodurch deine Wünsche und Anforderungen an die Behandlung nicht immer erfüllt werden können.3 Innovative Therapien sind daher notwendig.
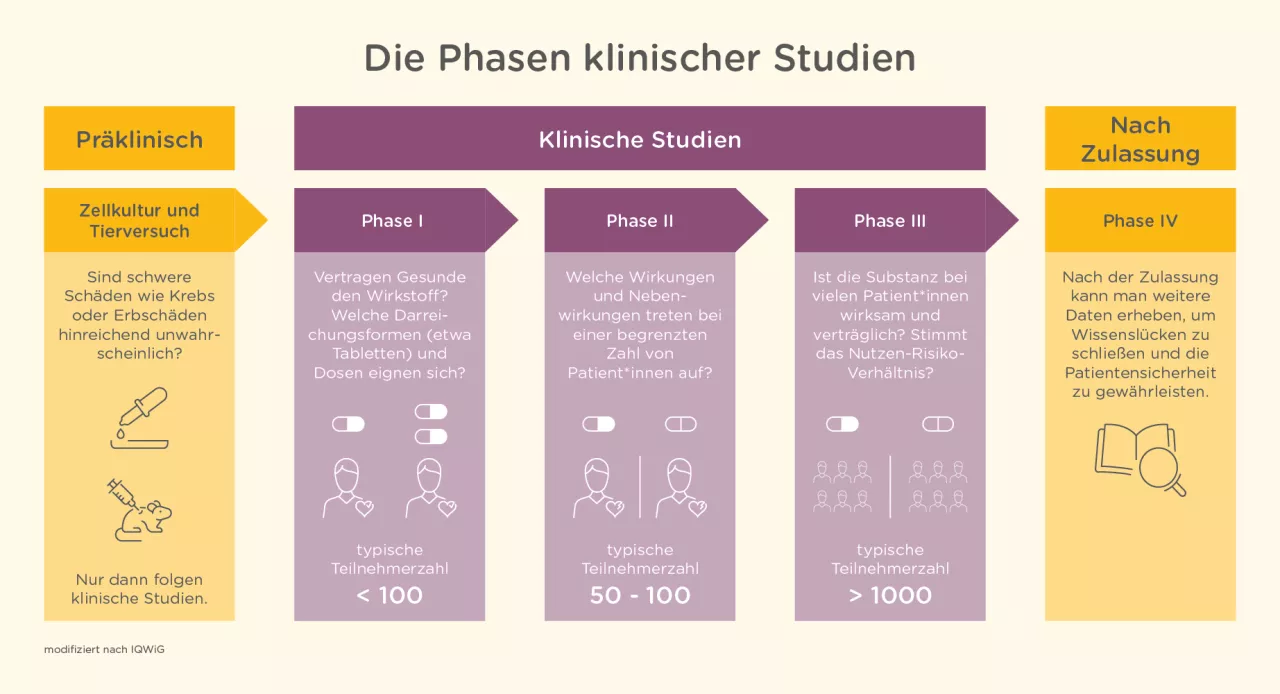
Medikamentenentwicklung: Mehrstufiger Prozess
Entdecken Wissenschaftler*innen eine vielversprechende Substanz, die z. B. im Entzündungsprozess der CED eine wichtige Rolle spielt, ist es noch ein weiter Weg, bis daraus ein fertiges Medikament entsteht. Die Substanz wird in mehreren klinischen Phasen genau geprüft – dieser Prozess kann insgesamt länger als 13 Jahre dauern.4
Präklinische Studien: Zunächst stellt sich die Frage, ob die Substanz giftig bzw. schädlich sein könnte. Da dies nicht an freiwilligen Probanden getestet werden darf, wird die Substanz in präklinischen Studien an Zellen und Tieren geprüft. Warum können die Untersuchungen nicht ausschließlich in der Zellkultur durchgeführt werden? Eine Zellkultur verhält sich anders als ein komplexer Organismus, weshalb auch beispielsweise Mäuse als Tiermodell herangezogen werden müssen.4 Doch auch das Tiermodell hat Schwachstellen: Bei Mäusen muss eine CED künstlich erzeugt werden, da diese von Natur aus keine chronisch-entzündlichen Darmerkrankungen entwickeln. Es ist noch nicht gänzlich geklärt, ob die hervorgerufene CED mit der menschlichen übereinstimmt, doch kann an dem Mausmodell geprüft werden, wie verträglich das Medikament ist.5 Bis zum Abschluss der präklinischen Tests vergehen typischerweise mehr als 5 Jahre.4
Klinische Studien: Nachdem der Wirkstoffkandidat in den präklinischen Studien an Zellen und Tieren getestet wurde, nehmen in der klinischen Phase erstmals Menschen die Substanz ein. Die klinische Entwicklung gliedert sich dabei in drei Phasen: In Phase-I-Studien wird geprüft, wie sich der Wirkstoff nach Einnahme im Körper verteilt und wie er vertragen wird. Die Daten werden genutzt, um die Darreichungsform des Medikaments zu entwickeln (z. B. Tabletten, Kapseln, etc.). In dieser Phase wird die Substanz an wenigen gesunden Erwachsenen getestet – üblicherweise an 60-80 Probanden.4 Handelt es sich um eine klinische Studie zu einer seltenen Erkrankung, kann die Anzahl der Teilnehmer*innen jedoch deutlich kleiner sein – auch in den nachfolgenden Phasen.6 Die Wirksamkeit und Verträglichkeit des potenziellen Medikaments wird in der Phase II an 100-500 Patient*innen getestet. Nachdem in Phase II auch eine optimale Dosierung für das neue Medikament festgelegt wurde, stehen in der Phase III mögliche Nebenwirkungen und Wechselwirkungen mit anderen Medikamenten im Fokus. Dafür ist eine Einbindung vieler Betroffener notwendig: Über 1.000 Patient*innen nehmen an Phase-III-Studien teil.4
Zulassung: Sind die klinischen Studien erfolgreich abgeschlossen, kann die Zulassung für das neue Medikament beantragt werden: Während die FDA (Food and Drug Administration, US-amerikanische Arzneimittelbehörde) für die Zulassung von Arzneimitteln in den Vereinigten Staaten zuständig ist, wird der Zulassungsantrag mitsamt Studiendaten zur Sicherheit und Wirksamkeit innerhalb der EU meist bei der EMA (European Medicines Agency, europäische Arzneimittelagentur) eingereicht. Nach eingehender Prüfung der Unterlagen spricht die EMA der Europäischen Kommission eine Empfehlung aus, die eine finale Zulassung erteilt. Die Bearbeitung eines Zulassungsantrags dauert im Schnitt 13 Monate.4
Zugelassene Medikamente unter Beobachtung
Nach der Zulassung des neuen Medikaments schließt sich die Phase IV an. Hierbei wird das Arzneimittel weiter von Hersteller und Behörden beobachtet, um sehr seltene Nebenwirkungen feststellen zu können. Diese betreffen weniger als eine von 10.000 Personen, weshalb sie in den klinischen Studien mit ca. 1.000 Patient*innen nicht beobachtet werden konnten.4 Um bereits zugelassene Medikamente noch sicherer zu machen, kannst auch du mithelfen: Ist dir bei der Einnahme eines Medikaments eine Nebenwirkung aufgefallen, solltest du deine Ärzt*innen darauf ansprechen. Ärzt*innen müssen Nebenwirkungen melden, aber auch du kannst deine Beobachtungen direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte mitteilen.7 Hier kommst du zu dem Online-Formular. Auch auf unserer Website kannst du eine Nebenwirkung melden unter https://www.ced-trotzdem-ich.de/kontakt.
Bis ein Medikament auf den Markt und für deine CED-Behandlung eingesetzt wird, musste es viele Etappen durchlaufen. Nur eine von 5.000 bis 10.000 Substanzen, die in der Forschung als Wirkstoffkandidaten erkannt und untersucht wurden, bekommt letztendlich die Zulassung als Medikament. Du kannst also sicher sein, dass die Medikamente, die dir verschrieben werden, gut geprüft und verträglich sind.4
Quellen:
- Kucharzik T, et al. Aktualisierte S3-Leitlinie Colitis ulcerosa – Living Guideline: Überprüfung 2021; AWMF-Registriernummer: 021-009.
- Sturm A, et al. Aktualisierte S3-Leitlinie „Diagnostik und Therapie des M. Crohn“ der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). 2021; AWMF-Registriernummer: 021-004.
- Schreiber S, et al. Therapeutic Interleukin-6 trans-signaling inhibition by olamkicept (sgp130Fc) in patients with active inflammatory bowel disease. Gastroenterology 2021; 160(7): 2354-2366.
- Die forschenden Pharma-Unternehmen (vfa). So entsteht ein neuen Medikament: https://www.vfa.de/print/de/arzneimittel-forschung/so-funktioniert-pharmaforschung/so-entsteht-ein-medikament.html (letzter Aufruf: 26.01.2022).
- Bundesministerium für Bildung und Forschung (BMBF). Darmzellen in Kultur erleichtern die Erforschung chronisch entzündlicher Darmerkrankungen: https://www.gesundheitsforschung-bmbf.de/de/darmzellen-in-kultur-erleichtern-die-erforschung-chronisch-entzundlicher-darmerkrankungen-1800.php (letzter Aufruf: 26.01.2022).
- Grouven U, et al. Seltene Erkrankungen: Randomisierte kontrollierte Studien auch hier der Goldstandard. Dtsch Arztebl 2015; 112(8): A-326 / B-280 / C-276.
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Online-Meldung von Nebenwirkungen: https://nebenwirkungen.bund.de/nw/DE/home/weitere-informationen-inhalt.html;jsessionid=D6E0F02616C222564DF539DDD38BF9E1.intranet172?nn=207148 (letzter Aufruf: 26.01.2022).